Rubidyum hakkında sunum. Ders sunumu “Alkali metaller. Alkali metal grubu şunları içerir:
Alkali metaller Periyodik Tablonun birinci grubunun ana alt grubunun elementleridir. Bu isim, alkali metallerin suyla reaksiyona girdiğinde kostik bir alkali oluşmasından kaynaklanmaktadır. Alkali metaller (artan atom numarasına göre) lityum (Li), sodyum (Na), potasyum (K), rubidyum (Rb), sezyum (Cs) ve fransiyumu (Fr) içerir. Alkali metaller Periyodik Tablonun birinci grubunun ana alt grubunun elementleridir. Bu isim, alkali metallerin suyla reaksiyona girdiğinde kostik bir alkali oluşmasından kaynaklanmaktadır. Alkali metaller (artan atom numarasına göre) lityum (Li), sodyum (Na), potasyum (K), rubidyum (Rb), sezyum (Cs) ve fransiyumu (Fr) içerir.
Alkali metallerin hazırlanması Alkali metaller bileşiklerde her zaman pozitif yüklü iyonlar halinde bulunur. Alkali metal atomları çok kolay oksitlendiğinden, elektronlarından vazgeçtiklerinden, iyonlarının indirgenmesi zordur. Bu nedenle, alkali metal iyonlarını azaltmak için genellikle en güçlü indirgeyici madde olan elektrik akımına başvururlar. Sodyum ve potasyum teknik olarak erimiş hidroksitlerin veya erimiş klorür tuzlarının elektrolizi ile üretilir; Lityum, erimiş lityum klorürün elektrolizi ile elde edilir. Rubidyum ve sezyum endüstriyel ölçekte üretilmez. Fransiyumun kararlı izotopları yoktur. Alkali metaller bileşiklerde her zaman pozitif yüklü iyonlar halinde bulunur. Alkali metal atomları çok kolay oksitlendiğinden, elektronlarından vazgeçtiklerinden, iyonlarının indirgenmesi zordur. Bu nedenle, alkali metal iyonlarını azaltmak için genellikle en güçlü indirgeyici madde olan elektrik akımına başvururlar. Sodyum ve potasyum teknik olarak erimiş hidroksitlerin veya erimiş klorür tuzlarının elektrolizi yoluyla üretilir; Lityum, erimiş lityum klorürün elektrolizi ile elde edilir. Rubidyum ve sezyum endüstriyel ölçekte üretilmez. Fransiyumun kararlı izotopları yoktur.


Fiziksel özellikler Alkali metaller gümüşi beyaz maddelerdir, ancak Alkali metaller altın rengi olan sezyum hariç gümüşi beyaz maddelerdir. Yumuşaktır, erime noktaları ve yoğunluğu düşüktür. Grupta yukarıdan aşağıya doğru erime ve kaynama noktaları düşer, metallerin yoğunluğu artar. Tüm bu metaller vücut merkezli kübik hücreler halinde kristalleşir. Yukarıdan aşağıya doğru hücre parametreleri artar ve buna bağlı olarak bağlantı kuvvetleri azalır. Dolayısıyla erime noktasında azalma olur. Ancak hacimdeki artışa rağmen çekirdeğin kütlesi artar. Potasyum için atom yarıçapında sodyumla karşılaştırıldığında keskin bir artış vardır ve hacmin etkisi kütleye üstün gelir, bu da yoğunlukta keskin bir azalmaya yol açar. Sodyum ve potasyum alaşımının hazırlanması. Her iki metal de bıçakla serbestçe kesilebilir

Alkali metallerin sofra metalindeki fiziksel özellikleri erime t, °C kaynama t, °C d, g/cm 3. Mohs sertliği ρ10 6, ohm Li Li Na Na K Rb Rb Cs Cs Fr Fr179,097,863,538,728,620,5390,9730, 8931 ,5341.9042.4400.60.40.50.3 0.2 8.554.346.1011.619.0


Suyla reaksiyon Alkali metallerin karakteristik bir özelliği, yanma ve patlamadan önce suyla çok aktif bir reaksiyona girmesidir: Alkali metallerin karakteristik bir özelliği, yanma ve patlamadan önce suyla çok aktif bir reaksiyona girmesidir: 2Na + 2H 2 O = 2NaOH + H 2 2K + 2H 2 O = 2KOH + H 2 Hidroksit ve hidrojen oluşur Su ile etkileşim

Sunum Anton Bernstein - baş bilimsel editör Viktor Pirozhkov - teknik editör tarafından hazırlandı. Toplanan materyal: Toplanan materyal: Nikolay Maslatsov - keşfin tarihi; Berdnikov Alexander - oksitler ve hidroksitler; Primenko Alena – alma; Arslanova Ksenia – fiziksel özellikler; Bernstein ve Pirozhkov – kimyasal özellikler; Çizimler: Pirozhkov Victor, Arslanova Ksenia Çizimler: Pirozhkov Victor, Arslanova Ksenia Anlatan: Bernstein Anton, Maslatsov Nikolay Anlatan: Bernstein Anton, Maslatsov Nikolay

Lityum Lityum, 1817 yılında İsveçli kimyager A. Arfvedson tarafından petalit mineralinde keşfedildi; Yunancadan isim litos taşı. Lityum metali ilk kez 1818'de İngiliz kimyager G. Davy tarafından elde edildi. Lityum, 1817 yılında İsveçli kimyager A. Arfvedson tarafından petalit mineralinde keşfedildi; Yunancadan isim litos taşı. Lityum metali ilk kez 1818'de İngiliz kimyager G. Davy tarafından elde edildi. Gümüşi beyaz renkte yumuşak alkali metal. Gümüşi beyaz renkte yumuşak alkali metal.

Sodyum Sodyum, sofra tuzu NaCl, soda Na 2 CO 3'ün doğal bileşikleri eski çağlardan beri bilinmektedir. "Sodyum" ismi Arapça'dan gelmektedir. natrun, Yunanca nitron, başlangıçta doğal soda olarak anılırdı. Zaten 18. yüzyılda. kimyagerler başka birçok sodyum bileşiğini biliyorlardı. Bununla birlikte, metalin kendisi yalnızca 1807'de G. Davy tarafından kostik soda NaOH'nin elektrolizi ile elde edildi. Birleşik Krallık'ta, ABD'de, Fransa'da elemente sodyum (İspanyolca soda kelimesinden), İtalya'da sodio adı verilir. Doğal bileşikler Sodyum sofra tuzu NaCl, soda Na 2 CO 3 eski çağlardan beri bilinmektedir. "Sodyum" ismi Arapça'dan gelmektedir. natrun, Yunanca nitron, başlangıçta doğal soda olarak anılır. Zaten 18. yüzyılda. kimyagerler başka birçok sodyum bileşiğini biliyorlardı. Bununla birlikte, metalin kendisi yalnızca 1807'de G. Davy tarafından kostik soda NaOH'nin elektrolizi ile elde edildi. Birleşik Krallık'ta, ABD'de, Fransa'da elemente sodyum (İspanyolca soda kelimesinden), İtalya'da sodio adı verilir. Sodyum, gümüş-beyaz renkte yumuşak bir alkali metaldir. Sodyum, gümüş-beyaz renkte yumuşak bir alkali metaldir. Sodyum, bıçakla kesilebilen yumuşak bir metaldir. Sodyum yumuşak bir metaldir ve bıçakla kesilebilir.

Rubidyum Rubidyum, 1861 yılında R. Bunsen ve G. Kirchhoff tarafından maden sularından izole edilen tuzların spektral bir çalışması sırasında keşfedildi. Elementin adı, spektrumun en karakteristik kırmızı çizgilerinin rengiyle verilir (Latince rubidus kırmızısından, koyu kırmızıdan). Metalik R. ilk kez 1863'te Bunsen tarafından kabul edildi. Rubidyum, 1861 yılında R. Bunsen ve G. Kirchhoff tarafından maden sularından izole edilen tuzların spektral çalışması sırasında keşfedildi. Elementin adı, spektrumun en karakteristik kırmızı çizgilerinin rengiyle verilir (Latince rubidus kırmızısından, koyu kırmızıdan). Metalik R. ilk kez 1863'te Bunsen tarafından kabul edildi. Yumuşak, gümüşi beyaz, son derece reaktif metal Yumuşak, gümüşi beyaz, son derece reaktif metal

Potasyum Bazı potasyum bileşikleri (örneğin odun külünden elde edilen potas) antik çağlardan beri biliniyordu; ancak sodyum bileşiklerinden ayırt edilemediler. Sadece 18. yüzyılda. “bitkisel alkali” (potas K2C03) ve “mineral alkali” (soda Na2C03) arasındaki fark gösterilmiştir. 1807'de G. Davy, hafifçe nemlendirilmiş katı kostik potasyum ve sodanın (koh ve naoh) elektrolizi ile potasyum ve sodyumu izole etti ve bunlara potasyum ve sodyum adını verdi. 1809'da L. V. Gilbert "potasyum" (Arapça'dan: al-kali potas) ve "sodyum" (Arapça'dan: natrun doğal soda) adlarını önerdi; I.Ya. Berzelius, ikincisini 1811'de “sodyum” olarak değiştirdi. “Potasyum” ve “sodyum” isimleri Büyük Britanya, ABD, Fransa ve diğer bazı ülkelerde korunmaktadır. Rusya'da bu isimler 1840'larda kullanıldı. yerini Almanya, Avusturya ve İskandinav ülkelerinde kabul edilen “potasyum” ve “sodyum” aldı. Bazı potasyum bileşikleri (örneğin odun külünden elde edilen potas) antik çağlarda zaten biliniyordu; ancak sodyum bileşiklerinden ayırt edilemediler. Sadece 18. yüzyılda. “bitkisel alkali” (potas K2C03) ve “mineral alkali” (soda Na2C03) arasındaki fark gösterilmiştir. 1807'de G. Davy, hafifçe nemlendirilmiş katı kostik potasyum ve sodanın (koh ve naoh) elektrolizi ile potasyum ve sodyumu izole etti ve bunlara potasyum ve sodyum adını verdi. 1809'da L. V. Gilbert "potasyum" (Arapça'dan: al-kali potas) ve "sodyum" (Arapça'dan: natrun doğal soda) adlarını önerdi; I.Ya. Berzelius, ikincisini 1811'de “sodyum” olarak değiştirdi. “Potasyum” ve “sodyum” isimleri Büyük Britanya, ABD, Fransa ve diğer bazı ülkelerde korunmaktadır. Rusya'da bu isimler 1840'larda kullanıldı. yerini Almanya, Avusturya ve İskandinav ülkelerinde kabul edilen “potasyum” ve “sodyum” aldı. Potasyum Potasyum gümüşi beyaz renkte yumuşak bir alkali metaldir. gümüşi beyaz renkte yumuşak alkali metal.

Sezyum Sezyum, 1860 yılında R. W. Bunsen ve G. R. Kirchhoff tarafından Durkheim mineral kaynağının (Almanya) sularında spektral analiz yöntemi kullanılarak keşfedildi. Sezyum, spektrumun mavi kısmındaki iki parlak çizgisi nedeniyle (Latince caesius gök mavisinden) adını almıştır. Metalik Sezyum ilk olarak 1882'de İsveçli kimyager K. Setterberg tarafından erimiş cscn ve ba karışımının elektrolizi ile izole edildi. Sezyum, 1860 yılında R. W. Bunsen ve G. R. Kirchhoff tarafından Durkheim mineral kaynağının (Almanya) sularında spektral analiz yöntemi kullanılarak keşfedildi. Sezyum, spektrumun mavi kısmındaki iki parlak çizgisi nedeniyle (Latince caesius gök mavisinden) adını almıştır. Metalik Sezyum ilk olarak 1882'de İsveçli kimyager K. Setterberg tarafından erimiş cscn ve ba karışımının elektrolizi ile izole edildi. Ampulde %99,99999 Sezyum Ampulde %99,99999 Sezyum Yumuşak alkali metal, altın-beyaz renk Yumuşak alkali metal, altın-beyaz renk

Fransiyum Alkali metallerin en ağır analogunun varlığı ve temel özellikleri 1870 yılında D.I. Mendeleev tarafından tahmin edilmişti, ancak uzun süre bu elementi doğada tespit etme girişimleri başarısızlıkla sonuçlandı. Ancak 1939'da Fransız araştırmacı M. Perey, 1000 olaydan 12'sinde 227 Ac çekirdeğinin bir (alfa) parçacığı yaydığını ve aynı zamanda Perey'in kütle numarası 223 olan 87 numaralı elementin çekirdeğine geçtiğini kanıtlamayı başardı. yalıtılmış. Araştırmacı yeni elemente anavatanının adını verdi. Alkali metallerin en ağır analogunun varlığı ve temel özellikleri 1870 yılında D.I. Mendeleev tarafından tahmin edilmişti, ancak uzun süre bu elementi doğada tespit etme girişimleri başarısızlıkla sonuçlandı. Ancak 1939'da Fransız araştırmacı M. Perey, 1000 olaydan 12'sinde 227 Ac çekirdeğinin bir (alfa) parçacığı yaydığını ve aynı zamanda Perey'in kütle numarası 223 olan 87 numaralı elementin çekirdeğine geçtiğini kanıtlamayı başardı. yalıtılmış. Araştırmacı yeni elemente anavatanının adını verdi. Fransiyum, hem radyoaktif hem de kimyasal olarak oldukça reaktif olan bir alkali metaldir. Fransiyumun kararlı izotopları yoktur, hem radyoaktiviteye hem de yüksek kimyasal aktiviteye sahip bir alkali metaldir. Kararlı izotopları yoktur Fransiyum-223 (izotopların en uzun ömürlü olanı francium'dur, yarı ömrü 22,3 dakikadır) radyoaktif uranyum-235 serisinin yan dallarından birinde bulunur ve doğal uranyum minerallerinden izole edilebilir Uranyum ( 235), Uranyum (235), Fransa'dan öğrendikleri

Oksitler Alkali metal oksitleri - Me 2 O tipi O ile bileşikleri: Alkali metal oksitleri - Me 2 O tipi O ile bileşikleri: O 2- O 2- O 2- O 2- Na + Na + Li + Li + Bazik oksitler, çünkü NaOH hidroksitlere karşılık gelirler; LiOH. Oksitler baziktir, çünkü NaOH hidroksitlerine karşılık gelirler; LiOH.

Oksitlerin oluşumu Lityum oksit, lityumun oksijen ile reaksiyonu sonucu oluşur: Lityum oksit, lityumun oksijen ile reaksiyonu sonucu oluşur: 4Li + O 2 = 2Li 2 O (t) Aşağıdaki örneği kullanarak diğer oksitlerin oluşumunu ele alalım. sodyum: I 2Na + O 2 = Na 2 O 2 (peroksit Na–O–O–Na) II 2Na + Na 2 O 2 = 2Na 2 O (t) I – aktif aşama II – kalsinasyon Ayrıca tuzların ayrışmasıyla da oluşur Oksijen içeren asitlerin ilgili metallerle (karbonatlar ve sülfitler) karşılık gelen metaller: Ayrıca tuzların (karbonatlar ve sülfitler) oksijen içeren asitlerin karşılık gelen metallerle ayrışmasıyla da oluşur: K 2 CO 3 K 2 O + CO 2 Li 2 SO 3 Li 2 O + SO 2 (t)

Hidroksitler Li dışındaki alkali metallerin hidroksitleri ısıya dayanıklıdır ve sıcaklıkla tahrip edilmez. Li hariç alkali metal hidroksitler ısıya dayanıklıdır ve sıcaklıkla tahrip edilmez. Hidroksitlerin reaksiyona girmesi Hidroksitlerin Asitlerle reaksiyona girmesi Asidik Asidik oksitler Asidik TuzlarTuzlar (çözünmeyen bir baz oluştuğunda). Tuzlar

Hidroksitlerin oluşumu Ters reaksiyon: oksit + su = hidroksit Ters reaksiyon: oksit + su = hidroksit K 2 O + H 2 O = 2KOH Alkali metal hidroksitler, OH grubu içeren bileşiklerdir. Genel formülleri şöyledir: MeOH; çözünür Na – O – H Li – O – H Na – O – H Li – O – H Potasyumun yanması (mor renkte)


Sunum önizlemelerini kullanmak için bir Google hesabı oluşturun ve bu hesaba giriş yapın: https://accounts.google.com
Slayt başlıkları:
OSAOU Engelli Çocukların Uzaktan Eğitim Merkezi "Belgorod Mühendislik Yatılı Gençlik Okulu" ALKALI METALS Tamamlayan: Bykova O.S., kimya öğretmeni
Amaç: Metallerin özelliklerini tekrarlamak, alkali metaller hakkındaki bilgileri karşılaştırmalı özelliklerine göre sistematikleştirmek ve derinleştirmek. Alkali metallerin fiziksel ve kimyasal özellikleri hakkında kavram oluşturmak.
Atomların yapısı ve özellikleri
Alkali metaller grup I'in ana alt grubunun elemanlarıdır: lityum Li, sodyum Na, potasyum K, rubidyum Rb, sezyum Cs, francium Fr.
Dış enerji seviyesinde, bu elementlerin atomlarının her biri, çekirdeğe nispeten büyük bir mesafede bulunan bir elektron içerir. Bu elektronu kolayca verirler, dolayısıyla çok güçlü indirgeyici maddelerdirler. Tüm bileşiklerinde alkali metaller +1 oksidasyon durumu sergiler. İndirgeyici özellikleri Li'den Cs'ye geçiş sırasında artar, bu da atomlarının yarıçapındaki artışla ilişkilidir. Bunlar metallerin en tipik temsilcileridir: metalik özellikleri özellikle belirgindir.
Alkali metaller - basit maddeler
Yeni kesilmiş yüzeyde karakteristik bir parlaklığa sahip, gümüşi beyaz yumuşak maddeler (bıçakla kesilmiş). Hepsi hafif ve eriyebilirdir ve kural olarak yoğunlukları Li'den Cs'ye artar ve tam tersine erime noktası düşer.
Kimyasal özellikler
Tüm alkali metaller son derece aktiftir, tüm kimyasal reaksiyonlarda indirgeyici özellikler gösterir ve tek değerlik elektronunu vererek pozitif yüklü bir katyona dönüşür. Basit maddeler (metal olmayanlar, oksitler, asitler, tuzlar, organik maddeler) oksitleyici madde görevi görebilir.
Metal olmayanlarla etkileşim
Alkali metaller oksijenle kolayca reaksiyona girer, ancak her metal kendi bireyselliğini gösterir: oksit yalnızca lityum oluşturur: 4Li + O2 = 2Li2O, sodyum peroksiti oluşturur: 2Na + O2 = Na2O2, potasyum, rubidyum ve sezyum süperoksiti oluşturur: K + O2 = KO2 .
Hidrojen, kükürt, fosfor, karbon, silikon ile etkileşim ısıtıldığında meydana gelir: hidrojen hidrürler oluşur: 2Na + H2 = 2NaH, kükürt - sülfürler ile: 2K + S = K2S, fosfor - fosfitler ile: 3K + P = K3P, ile silikon – silisitler: 4Cs + Si = Cs4Si, karbon karbürler lityum ve sodyum oluşturur: 2Li + 2C = Li2C2
Yalnızca lityum nitrojenle kolayca reaksiyona girer; reaksiyon oda sıcaklığında lityum nitrürün oluşmasıyla gerçekleşir: 6Li + N2 = 2Li3N. Halojenlerle tüm alkali metaller halojenürler oluşturur: 2Na + Cl2 = 2NaCl.
Su ile etkileşim
Tüm alkali metaller suyla reaksiyona girer, lityum sessizce reaksiyona girer, suyun yüzeyinde yüzer, sodyum sıklıkla tutuşur ve potasyum, rubidyum ve sezyum patlayıcı bir şekilde reaksiyona girer:
Alkali metaller, hidrojen açığa çıkarmak için seyreltik asitlerle reaksiyona girebilir, ancak metal suyla da reaksiyona gireceğinden reaksiyon belirsiz olacaktır ve daha sonra ortaya çıkan alkali, asit tarafından nötrleştirilecektir. Oksitleyici asitlerle, örneğin nitrik asitle etkileşime girdiğinde, reaksiyonun seyri de belirsiz olmasına rağmen, bir asit indirgeme ürünü oluşur. Alkali metallerin asitlerle etkileşimine hemen hemen her zaman bir patlama eşlik eder ve bu tür reaksiyonlar pratikte gerçekleştirilmez. Asitlerle etkileşim
Alkali metal bileşikleri Alkali metaller, son derece yüksek kimyasal aktiviteleri nedeniyle doğada serbest halde bulunmaz. Doğal bileşiklerinden bazıları, özellikle sodyum ve potasyum tuzları oldukça yaygındır; birçok mineralde, bitkide ve doğal sularda bulunurlar.
Sodyum hidroksit NaOH, teknolojide kostik soda, kostik soda, kostik soda isimleri altında bilinir. Potasyum hidroksit KOH'un teknik adı kostik potastır. Her iki hidroksit de (NaOH ve KOH), kumaşları ve kağıdı aşındırır, bu nedenle bunlara kostik alkaliler de denir. Kostik soda, petrol ürünlerinin saflaştırılmasında, kağıt ve tekstil endüstrilerinde, sabun ve elyaf üretiminde büyük miktarlarda kullanılmaktadır. Kostik potasyum daha pahalıdır ve daha az kullanılır. Ana uygulama alanı sıvı sabun üretimidir.
Alkali metal tuzları iyonik yapıya sahip katı kristal maddelerdir. . Na2СO3 - sodyum karbonat, cam, kağıt ve sabun üretiminde kullanılan, kristal soda olarak bilinen kristalli hidrat Na2СO3 * 10Н2O'yu oluşturur. Günlük yaşamda asit tuzuna daha aşinasınız - sodyum bikarbonat NaHCO3, gıda endüstrisinde (kabartma tozu) ve tıpta (kabartma tozu) kullanılır. K2C03 - potasyum karbonat, teknik adı - sıvı sabun üretiminde kullanılan potas. Na2SO4 10H2O - sodyum sülfatın kristal hidratı, teknik adı - Glauber tuzu, soda ve cam üretiminde ve müshil olarak kullanılır.
NaCl - sodyum klorür veya sofra tuzu, bu tuzu geçen yılki kurstan iyi biliyorsunuz. Sodyum klorür kimya endüstrisindeki en önemli hammaddedir ve günlük yaşamda yaygın olarak kullanılmaktadır.
İlginiz için teşekkür ederiz!

Metal atomlarının dış seviyelerinde 1-3 elektron bulunur.
Metaller indirgeyici ve oksitleyici maddelerdir.
Metaller metalik bir kristal kafes ile karakterize edilir.
Metallerin elektriksel iletkenliği ve termal iletkenliği vardır.
Oksijenle etkileşime girdiğinde metaller elektronları kabul eder.
Slayt metaller konusundaki bilgileri güncellemek için kullanılır
Tüm metaller asitlerle aktif olarak etkileşime girer.
C u, Au, Ag metalleri ısıtıldığında bile suyla etkileşime girmez.
M g, Be toprak alkali metallere aittir.

Alkali metallerin genel tanımını yapınız.
Elektronik yapılarını göz önünde bulundurun, fiziksel ve kimyasal özelliklerini karşılaştırın.
En önemli metal bileşikleri ve bunların ortak adları hakkında bilgi edinin.
Bu bileşiklerin uygulama alanlarını belirleyiniz.

ALKALİ METALLERİN KEŞFİ
- Lityum İsveçli kimyager J. Arvedson tarafından keşfedildi. 1817, J. Berzelius'un önerisi üzerine lityum (Yunanca'dan. lito - taş)
- Sodyum ve potasyum ilk olarak 1807 yılında İngiliz kimyager ve fizikçi G. Davy tarafından kostik alkalilerin elektrolizi yoluyla elde edildi.
- J. Berzelius yeni bir elemente sodyum (Arap'tan) denmesini önerdi. natrun - soda) ve Gilbert'in önerisiyle ikinci elemente potasyum denir (Arapça'dan. alkali – alkali )
Humphry Davy
(1778 – 1829)
Jens-Jakob Berzelius (1779–1848)

- 1860 - 1861'de Almanya'da R. Bunsen ve G. Kirchhoff "koyu kırmızı" rubidyum ve "gök mavisi" sezyumu keşfettiler.
- 1939'da Fransa'da M. Pere, ülkesi Fransa'nın adını verdiği radyoaktif element francium'u keşfetti.

Onarıcı özellikler
bağlantılar
Metalik özellikler
eleman
A R
Değerlik
elektronlar
Atom yarıçapı
Li 2 O, LiOH
Temel özellikler
2'ler 1
Hayır 2 O, NaOH
Temel özellikler
3'ler 1
k 2 Ah, KOH
Temel özellikler
4'ler 1
Rb 2 O, RbOH
Temel özellikler
Yeni materyal öğrenme. Tüm bilgiler hemen ortaya çıkmaz, ancak öğrencilerle yapılan bir görüşme sırasında onların görüşlerini kontrol etmek ve tablodaki konumlarına göre alkali metallerin genel bir tanımını birlikte vermek mümkündür.
5'ler 1
C'ler 2 O, CsOH
Temel özellikler
6'lı 1
Radyoaktif
eleman
7'ler 1

Alkali metaller

Fiziki ozellikleri
Alkali metaller eriyebilir ve yumuşaktır, gümüş rengindedir, kartopu gibi...
Lityum yumuşak ve esnektir, sodyumdan daha sert fakat kurşundan daha yumuşaktır
Sodyum yumuşak bir metaldir ve bıçakla kesilebilir.
Ampuldeki metal rubidyum
Ampuldeki sezyum metali

Gümüşi beyaz katılar
Elektriksel olarak iletken ve termal olarak iletken
Düşük eriyebilir. plastik


METAL AKTİVİTE SERİSİ / ELEKTROKİMYASAL GERİLİM SERİSİ
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Bi Cu Hg Ag Pt Au
NaCl – sofra (kaya) tuzu
Na 2 SO 4 * 10H 2 O – Glauber tuzu
NaCl*KCl – silvinit
KCI* MgCl 2 *6H 2 O – karnalit
Hayır +
Cl -
Hayır +
Cl -
Cl -
Hayır +
Hayır +
Cl -
2NaCl → 2Na + Cl 2
NaCl → Na + + Cl -
taş
silvinit
Glauberova
karnalit

Doğada olmak
Ortoklaz
Sodyum klorit
Formül K(A lSi 3 O 8)
Formül NaCl
Formül Na
Karnalit
Silvinit
Formül NaCl KCl
Formül KCl MgCl 2 6H 2 O
Formül KCl

Alkali metallerin su, oksijen ve nitrojene göre yüksek kimyasal aktivitesi nedeniyle bir kerosen tabakası altında depolanırlar. Alkali metal ile reaksiyonu gerçekleştirmek için, gazyağı tabakası altında bir neşter ile gerekli büyüklükte bir parça dikkatlice kesilir, metal yüzey argon atmosferinde hava ile etkileşiminin ürünlerinden iyice temizlenir ve sadece daha sonra numune reaksiyon kabına yerleştirilir.

1. Me + su = metal hidroksit + hidrojen
Tüm alkali metaller suyla aktif reaksiyona girerek alkaliler oluşturur ve suyu hidrojene indirger:
2Ben 0 + 2 saat 2 Ç = 2Me +1 OH + H 2
2Na+ 2 saat 2 Ö = 2NaOH + H 2
Bir alkali metalin suyla etkileşim hızı lityumdan sezyuma doğru artar

2. Oksijen ile etkileşim
- Sadece lityum Stokiyometrik bileşime sahip bir oksit oluşturmak için havada yanar:
Yanarken sodyum esas olarak Na202 peroksit, küçük bir NaO2 süperoksit karışımıyla oluşturulur:
- Yanma ürünlerinde potasyum , rubidyum Ve sezyum esas olarak süperoksitler içerir:

3 . Diğer maddelerle etkileşim
Alkali metaller birçok ametalle reaksiyona girer. Isıtıldıklarında hidrojen ile birleşerek hidritler oluştururlar; halojenler, kükürt, nitrojen, fosfor, karbon ve silikon ile sırasıyla aşağıdakileri oluştururlar: halojenürler , sülfürler , nitrürler , fosfitler, karbürler Ve silisitler :



Alkali metal oksitler, bazik oksitlerin tüm özelliklerine sahiptir: su, asidik oksitler ve asitlerle reaksiyona girerler:
Bazik oksitler



Gıda endüstrisi
Sabun üretimi
Sodyum hidroksit
Hidroklorik asit

Na+ kanda ve lenfte bulunan, hücrelerde ozmotik basınç oluşturan hücre içi bir iyondur.
K+, kalbin ve kasların işleyişini destekleyen hücre dışı bir iyondur.

Tuzlu su çözeltisi hazırlamak için ne kadar su ve sodyum klorür almanız gerekir?
0,5 kg ağırlığında mı?
4.5g tuz
495,5 gr su
15 g ağırlığındaki bir sodyum klorür ve sodyum bikarbonat karışımı asetik asit ile işlendi ve 2,8 l (n.s.) gaz açığa çıktı. Karışımın bileşenlerinin kütle yüzdelerini belirleyin.
Potasyum klorür çok değerli bir mineral gübredir. Bu maddedeki potasyumun kütle fraksiyonunu (%) hesaplayın.
70% NaHCO 3
%30 NaCl
Tuzların önemsiz isimleri:
Tuz
Tıpta sodyum klorür çözeltisi (%0,9) kullanılır. Bu çözüme fizyolojik denir.
Kabartma tozu yemek pişirmede ve şekerleme ürünlerinin pişirilmesinde kullanılır.
Sodyum klorür - gıda katkı maddesi olarak
Potasyumlu gübreler bitki yaşamında önemli bir rol oynar.
Slaydın çalışması için herhangi bir mavi dikdörtgene tıklamanız gerekir. 1-3 tablo hücresi için bu bir görevdir. Hücre 4 için - maddelerin önemsiz isimlerine ilişkin bilginin test edilmesi.
Kristal soda
Na 2 CO 3 *10H 2 O
Potasyum nitrat
Na 2 SO 4 *10H 2 Ö
Glauber tuzu
Karbonat

Görev No.1.
Satırdaki "ekstra" öğeyi tanımlayın.
A) Fr, K, Cu, Na;
B) P, Li, O, Cl;
B) Al, Ag, Ra, Cs.
Seçimini açıkla.

Görev No.2.
Alev uygun renge boyanırsa resimde hangi metalin yandığını görüyorsunuz?

Alkali metal iyonlarıyla alev renklendirme
Li +
Hayır +
k +
C'ler +

Görev No.3.
İsveçli kimyager Johan Arfvedson, 1817'de E2O formülüyle yeni bir kimyasal elementin oksitinin özelliklerini inceledi. Bu oksit beyazdı, suyla kuvvetli bir şekilde reaksiyona girerek güçlü EON bazını oluşturdu ve asitlerle tuzlar verdi. E2O alkalilerle reaksiyona girmedi, ancak atmosferde CO2 karbonat E2CO3'e dönüştü ve fosfor oksit (V) ile birleştirildiğinde ortofosfat E3PO4 verdi. Hem karbonat hem de ortofosfat suda çok az çözünürdü. Aleve E2O tozu eklendiğinde karmin kırmızısına dönüştü. Arfvedson hangi oksit üzerinde çalıştı? Bahsedilen tüm reaksiyonları yazın.

1)Li 2 O + H 2 O →2LiOH
2) Li 2 O + 2HNO 3 → 2LiNO 3 + H 2 O
3) Li 2 O + C02 → Li 2 C03
4) 3Li 2 O + P 2 Ö 5 → 2Li 3 PO 4

Elektronegatiflik
Lityumdan fransiyuma alkali metal atomlarının sayısı artar
değerlik elektronlarının sayısı
oksitleyici özellikler
onarıcı özellikler
Daha güçlü bir indirgeyici ajan
K ne olacak
Hepsinden en aktif
suyla etkileşime girecek
Na tepki verebilir
grubun tüm maddeleri ile
CO 2 , H 2 , C
İLE bir, H 2 O, Cl 2
Bu görevi tamamlarken doğru cevabı seçmeli ve farenin sol tuşuyla tıklamalısınız.
N 2 , H 2 , H 2 Ö
NaOH, O 2 , S
Alkali metaller doğada şu şekillerde bulunur:
oksitler
tuzlar
serbest biçimde
sülfürler

Konsolidasyon
Reaksiyon denklemlerini kullanarak dönüşümleri gerçekleştirin:
1) Na → Na 2 Ö 2 → Na 2 Ö
NaOH → Na2C03
- Li → Li 2 O → LiOH → LiCl
1. Hangi metal su ile etkileşime girdiğinde alkali oluşturur?
2. Alkali metallerin elektronik formülünü belirleyin.
Özetleme
- Bugün şunu öğrendim...
- Şaşırmıştım...
- Ben istiyorum…
Ödev: § 11 s. 44-45, Kuznetsova N.E.'ye dönüş, Levkina No. 8-43, 8-53
Sezyum, spektral analizle keşfedilen ilk elementtir. Bunsen, yeni keşfedilen metale enlemlerden sezyum (Casium) adını verdi. caesius - mavi, açık gri; eski zamanlarda bu kelime berrak bir gökyüzünün maviliğini ifade ediyordu. Saf metalik sezyum 1882'de elektrolitik olarak elde edildi. Fransiyum, Mendeleev'in periyodik tablosunda "en son" keşfedilen dört elementten biridir. Nitekim 1925 yılına gelindiğinde element tablosunun 43, 61, 85 ve 87 hariç tüm hücreleri doldurulmuştu. Bu eksik elementleri keşfetmeye yönelik çok sayıda girişim uzun süre başarısız kaldı. 1939'da Paris'teki Curie Enstitüsü'nden Marguerite Perey, aktinyumun (Ac-227) preparatını çeşitli radyoaktif bozunma ürünlerinden arındırıyordu. Dikkatlice kontrol edilen operasyonlar yürüterek, o zamanlar bilinen aktinyum bozunma serisinin izotoplarından hiçbirine ait olamayacak beta radyasyonunu keşfetti. Yeni izotop geçici olarak AsK adını aldı. 1946'da Perey, 87. elemente anavatanının onuruna Fransa adını vermeyi önerdi.
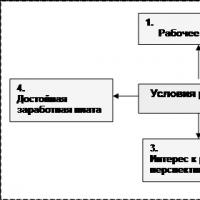 Girişimci ortam ve yapısı Bir ilişkiler sistemi olarak girişimci ortam
Girişimci ortam ve yapısı Bir ilişkiler sistemi olarak girişimci ortam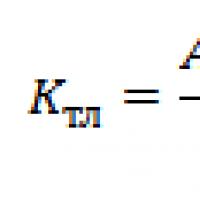 Bir işletmenin kredi itibarını analiz etmenin teorik yönleri
Bir işletmenin kredi itibarını analiz etmenin teorik yönleri Malların geçici ithalat süresinin ihlali
Malların geçici ithalat süresinin ihlali Teklifler aşağıdaki türlerdendir
Teklifler aşağıdaki türlerdendir Gümrük ücretleri Doğal gaza ilişkin ihracat gümrük vergileri
Gümrük ücretleri Doğal gaza ilişkin ihracat gümrük vergileri Oyunların kart dizini "Meslekler dünyasında" mesleğe göre Didaktik oyun konulu konuşma gelişimi için kart dizini (kıdemli grup)
Oyunların kart dizini "Meslekler dünyasında" mesleğe göre Didaktik oyun konulu konuşma gelişimi için kart dizini (kıdemli grup) Baş metrolog iş tanımı
Baş metrolog iş tanımı