Prezentare „corpuri cristaline și amorfe”. Prezentare de fizică „corpuri amorfe” Prezentare pe tema corpurilor cristaline
Slide 1
Corpuri cristaline și amorfe
Tensiunea superficială a lichidelor
Slide 2

Stări de bază ale materiei
Gazos Lichid Solid Cristale Corpuri amorfe Orice substanta poate fi in 3 stari de agregare, in functie de conditii (temperatura si presiune) Plasma
Slide 3

Cristalele sunt solide ale căror atomi sau molecule ocupă poziții specifice, ordonate în spațiu
În corpurile cristaline, particulele sunt dispuse într-o ordine strictă, formând structuri spațiale care se repetă periodic pe întregul volum al corpului (ordine pe distanță lungă pentru o reprezentare vizuală a unor astfel de structuri, spațială). rețele cristaline, la nodurile cărora se află centrele atomilor sau moleculelor unei substanțe date. Cel mai adesea, o rețea cristalină este construită din ioni (încărcați pozitiv și negativ) atomi care fac parte din molecula unei anumite substanțe.
Slide 4

Cristale
Se topește la o anumită temperatură (punct de topire) Proprietățile cristalului depind de tipul rețelei cristaline
Un monocristal este un singur cristal. Proprietăți fizice: 1) Forma geometrică corectă 2) Punct de topire constant.
Slide 5

Grile de cristal
Molecular Atomic Metalic Ionic
Moleculele sunt localizate la noduri. Între ele există forțe slabe de atracție, astfel încât substanțele sunt volatile, au puncte de topire și de fierbere scăzute și duritate scăzută. Gheață, iod. Nodurile conțin atomi individuali. Legăturile dintre ele sunt cele mai puternice, prin urmare substanțele sunt cele mai dure, nu se dizolvă în apă și au puncte de topire și de fierbere ridicate. Diamant (carbon) Nodurile conțin atomi de metal care se transformă ușor în ioni atunci când renunță la electroni pentru uz comun. Substantele sunt maleabile, plastice, au un luciu metalic, conductivitate termica si electrica ridicata. Nodurile contin ioni pozitivi si negativi. Legătura dintre ele este puternică, astfel încât substanțele sunt foarte dure, refractare, nevolatile, dar multe se pot dizolva în apă. Clorura de sodiu (sare)
Slide 6

Cristale
Slide 7

smarald columbian
Pălăria lui Monomakh
Slide 8

Policristale
Policristal de bismut
Ametist (un tip de cuarț)
Policristalele sunt solide formate dintr-un număr mare de cristale mici. Exemple: metale, o bucată de zahăr.
Slide 9

Anizotropia cristalului - dependența proprietăților fizice de direcția în interiorul cristalului
Rezistenta mecanica diferita in functie de directii diferite(mica, grafit) Conductivități termice și electrice diferite Proprietăți optice diferite ale cristalului (refracție diferită a luminii - cuarț) Toate corpurile cristaline sunt anizotrope
Slide 10

Corpuri amorfe
Acestea sunt solide în care se păstrează doar ordinea pe distanță scurtă în aranjarea atomilor. (Silice, rășină, sticlă, colofoniu, bomboane de zahăr). Nu au un punct de topire constant și sunt fluide. La temperaturi scăzute se comportă ca niște corpuri cristaline, iar la temperaturi ridicate se comportă ca niște lichide.
Slide 11

Corpurile amorfe sunt izotrope, proprietăți fizice la fel in toate directiile
Seva de copac amorfă, fosilizată
Slide 12

Cristale lichide
Posedă atât proprietățile unui cristal, cât și ale unui lichid (anizotropie și fluiditate) Cristalele lichide sunt în principal substanțe organice ale căror molecule au o formă de fir lung sau formă de plăci plate.
Slide 13

Lichide
În lichide, se observă ordinea pe distanță scurtă - un aranjament relativ ordonat (sau orientare reciprocă în cristale lichide) a particulelor lichide învecinate în volumele sale mici.
Slide 14

Lichide
Structura este similară cu structura corpurilor amorfe. Diferența: au o fluiditate ridicată.
Slide 15

Lichid
Fenomenele de suprafață sunt fenomene asociate cu existența unei suprafețe libere într-un lichid. Excesul de energie deținut de moleculele stratului de suprafață în comparație cu moleculele din grosimea lichidului se numește energie de suprafață (exces). Energia de suprafață specifică - raportul dintre energia de suprafață și aria suprafeței σ= Е suprafață/s [σ]=1 J/m2
Slide 16

Numărul de molecule rămase pe suprafața lichidului este astfel încât aria acestuia rămâne minimă pentru un anumit volum de lichid. Picăturile de lichid capătă o formă apropiată de sferică, în care suprafața este minimă. Forma proprie este sferică Tensiunea superficială este un fenomen cauzat de atracția moleculelor stratului de suprafață către moleculele din interiorul lichidului. Forța de tensiune superficială este o forță îndreptată tangențial la suprafața unui lichid, perpendicular pe secțiunea conturului care limitează suprafața, în direcția contracției acestuia.
Descrierea prezentării prin diapozitive individuale:
1 tobogan
Descriere slide:
2 tobogan
Descriere slide:
Asemănări și diferențe. În fizică, numai corpurile cristaline sunt numite de obicei solide. Corpurile amorfe sunt considerate a fi lichide foarte vâscoase. Nu au un punct de topire anume atunci când sunt încălzite, se înmoaie treptat și le scade vâscozitatea. Corpurile cristaline au un anumit punct de topire, neschimbat la presiune constantă. Corpurile amorfe sunt izotrope - proprietățile corpurilor sunt aceleași în toate direcțiile. Cristalele sunt anizotrope. Proprietățile cristalelor nu sunt aceleași în direcții diferite.
3 slide
Descriere slide:
Cristale. Studiu structura interna cristalele care utilizează radiații cu raze X au făcut posibilă stabilirea faptului că particulele din cristale au aranjamentul corect, adică formează o rețea cristalină. - Punctele din rețeaua cristalină care corespund celei mai stabile poziții de echilibru a particulelor unui solid se numesc noduri rețelei cristaline. În fizică, un solid înseamnă doar acele substanțe care au o structură cristalină. Există 4 tipuri de rețele cristaline: ionică, atomică, moleculară, metalică. 1. nodurile contin ioni; 2.atomi; 3.molecule; 4.+ ioni metalici
4 slide
Descriere slide:
Corpuri amorfe. Corpurile amorfe, spre deosebire de corpurile cristaline, care se caracterizează prin ordinea pe distanță lungă în aranjarea atomilor, au doar ordine pe distanță scurtă. Corpurile amorfe nu au propriul punct de topire. Când este încălzit, un corp amorf se înmoaie treptat, moleculele sale își schimbă din ce în ce mai ușor vecinii cei mai apropiați, vâscozitatea îi scade, iar la o temperatură suficient de ridicată se poate comporta ca un lichid cu vâscozitate scăzută.
5 slide
Descriere slide:
Tipuri de deformare. O schimbare în forma și dimensiunea corpului se numește deformare următoarele tipuri deformatii: 1.deformarea tensiunii longitudinale si compresiunii longitudinale; 2. deformarea întinderii și compresiei integrale; 3.deformarea la încovoiere transversală; 4.deformarea de torsiune; 5.deformare prin forfecare;
6 diapozitiv
Descriere slide:
Fiecare dintre tipurile de deformare descrise poate fi mai mare sau mai mică. Oricare dintre ele poate fi evaluat prin deformare absolută ∆o modificare numerică în orice dimensiune a unui corp sub influența forței. Deformarea relativă Ɛ (epsilon grecesc) este o mărime fizică care arată ce parte din dimensiunea inițială a corpului a este deformația absolută ∆a: Ɛ=∆L/L Ɛ= ∆a / a Efortul mecanic este o mărime care caracterizează acțiunea a forțelor interne într-un solid deformat. σ= F / S [Pa]
7 diapozitiv
Descriere slide:
Legea lui Hooke. Legea lui Hooke: solicitarea mecanică într-un corp deformat elastic este direct proporțională cu deformația relativă a acestui corp. σ=kƐ Valoarea k, care caracterizează dependența tensiunii mecanice dintr-un material de tipul acestuia din urmă și de condițiile externe, se numește modul elastic. σ=EƐ σ=E (∆L/L) E – modulul elastic „Modulul Young”. Modulul lui Young este măsurat prin efortul normal care trebuie să apară în material atunci când o deformare relativă egală cu unitatea, i.e. când lungimea probei este dublată. Valoarea numerică a modulului Young este calculată experimental și introdusă în tabel. Thomas Young
Corpuri cristaline și amorfe Completată de: Elena Anatolievna Gotmanova, profesor de fizică la Instituția Municipală de Învățământ „Școala Gimnazială Nr. 15”, r.p. Districtul Pervomaisky Shchekinsky 14.01.2008 REZUMAT Prezentarea poate fi folosită parțial în lecțiile de fizică din clasa a VIII-a și integral în clasa a X-a; pe activitati extracuriculare(săptămâni de fizică, seminarii, lecții cu conexiuni interdisciplinare) Realizat în Microsoft PowerPoint Volumul de lucru - , număr de diapozitive - 16 Scopuri și obiective Familiarizarea elevilor cu structura și proprietățile solidelor; Arătați rolul fizicii stării solide în crearea materialelor cu proprietăți predeterminate; Arătați formula cristalelor, simetria rețelelor cristaline spațiale; Spectacol semnificație practică solide Recomandări metodologice pentru profesor Această prezentare poate fi folosită în clasa a 10-a, cu două și trei ore alocate temei „Solide”; Pentru implementarea învățării diferențiate, rezolvarea problemelor de înaltă calitate poate fi oferită atât întregii clase, cât și parțial elevilor cu diferite niveluri de cunoștințe; La clasa a 8-a se pot folosi materiale de prezentare legate de studiul solidelor cristaline. Recomandări metodologice pentru studenți Această prezentare susține interesul pentru studiul fizicii; Folosind această prezentare, vă extindeți orizonturile, dezvoltați gândirea abstractă; Această prezentare vă permite să consolidați abilitățile de autoeducare. Caracteristicile structurii moleculare interne a solidelor. Proprietățile lor Cristalul este o formare stabilă, ordonată de particule în stare solidă. Cristalele se disting prin periodicitatea spațială a tuturor proprietăților. Principalele proprietăți ale cristalelor: păstrează forma și volumul în absența influențelor externe, are rezistență, un anumit punct de topire și anizotropie (diferența dintre proprietățile fizice ale cristalului față de direcția aleasă). Observarea structurii cristaline a unor substanțe sare cuarț mica diamant Monocristale și policristale Metalele au o structură cristalină. De obicei, un metal este format dintr-un număr mare de cristale mici topite împreună. Un solid format dintr-un număr mare de cristale mici se numește policristalin. Cristalele simple se numesc cristale simple. Majoritatea solidelor cristaline sunt policristale, deoarece constau din multe cristale intercrescute. Cristale simple - cristalele simple au o formă geometrică obișnuită și proprietățile lor variază în funcție de direcție Context istoric 1867 Inginerul rus A.V. Gadolin a fost primul care a demonstrat că cristalele pot avea 32 de tipuri de simetrie Renumitul cristalograf rus E.S. Fedorov a dovedit că pot exista doar 230 de moduri de a construi un cristal. Oamenii de știință au descoperit că forma corectă a unui cristal se datorează aranjamentului apropiat și ordonat al particulelor din cristal. Demonstrarea diferitelor modele de rețele cristaline sare de grafit de diamant. Observați aceeași distanță. între particulele de sare în anumite direcții Modelele de rețele cristaline de grafit și diamant sunt un exemplu de polimorfism, când aceeași substanță poate avea diferite tipuri de ambalare Demonstrarea dovezilor proprietăților corpurilor amorfe 1. Corpurile amorfe nu au un punct de topire specific parafină sticla 2. Corpii amorfi sunt izotropi, de exemplu: parafină, plastilină Rezistența acestor corpuri nu depinde de alegerea direcției de testare. Demonstrarea proprietăților corpurilor amorfe 3. La expunerea pe termen scurt, acestea prezintă proprietăți elastice. De exemplu: balon de cauciuc 4. Cu influență externă prelungită, curg corpuri amorfe. De exemplu: parafină într-o lumânare. 5. În timp, acestea devin tulburi (ex: sticlă) și se devitrifică (ex: bomboane), ceea ce este asociat cu apariția unor cristale mici, ale căror proprietăți optice diferă de proprietățile corpurilor amorfe Rezolvarea problemelor calitative A bila formata dintr-un singur cristal atunci cand este incalzita isi poate schimba nu numai volumul, ci si forma. De ce? Un cub de sticlă și un cub monocristal de cuarț scufundate în apă fierbinte. Cuburile își păstrează forma? De ce nu există cristale sferice în natură? De ce scârțâie zăpada sub picioare pe vreme rece? De ce nu există puncte de topire pentru sticlă în tabelele cu punctele de topire ale diferitelor substanțe? Rezultate Elevii s-au familiarizat cu structura și proprietățile solidelor; Ne-am familiarizat cu rolul fizicii stării solide în crearea materialelor cu proprietăți predeterminate; Elevii au văzut formula cristalelor, simetria rețelelor cristaline spațiale; Ne-am uitat la semnificația practică a solidelor Referințe 1. 2. 3. O.F. Fizica Kabardin. Materiale de referință Kabardin O.F - M. „Iluminismul”, 1988, 367 p. G.Ya. Myakishev, B.B. Buhovtsev, N.N. Sotsky – Fizică. Manual pentru clasa a X-a a instituțiilor de învățământ general. Myakishev G.Ya., Buhovtsev B.B., Sotsky N.N. - Literatură, „Iluminismul”, 2007, 366 p. IG. Vlasova, A.A. Vitebskaya Rezolvarea problemelor de fizică. Manualul elevului școlar. – Vlasova I.G., Vitebskaya A.A., Societatea Filologică „Slovo”, AST, Klyuch-S, Centrul pentru Științe Umaniste de la Facultatea de Jurnalism a Universității de Stat din Moscova. M.V. Lomonosov, -M., 1997, 638 p. Răspunsuri la probleme calitative Un monocristal este un singur cristal ale cărui proprietăți fizice depind de direcția în interiorul cristalului, adică are anizotropie. Prin urmare, o minge dintr-un singur cristal, atunci când este încălzită, se poate extinde în diferite direcții în mod inegal, prin urmare, își poate schimba nu numai volumul, ci și forma. Sticla este un solid amorf și este izotropă. Monocristalele sunt anizotrope. În consecință, datorită anizotropiei dilatației termice (dilatația termică nu este aceeași în direcții diferite), cubul de cuarț va lua forma unui paralelipiped. Un cub de sticlă nu își va schimba forma. Toate cristalele simple sunt anizotrope, adică proprietățile fizice depind de direcția din interiorul cristalelor. În consecință, creșterea cristalelor nu este aceeași în direcții diferite și, prin urmare, un cristal sferic nu poate fi crescut. Zăpada este formată dintr-un număr mare de fulgi de zăpadă cristalini. Pe vreme rece, zăpada scârțâie sub picioarele tale pentru că sute de mii de cristale se sparg pe podea sub forța picioarelor tale. Acest lucru se datorează faptului că sticla este o substanță amorfă care nu are un punct de topire specific.


Cu mulți ani în urmă, în Sankt Petersburg, într-unul din depozitele neîncălzite, erau stocuri mari de nasturi albi lucioși de tablă. Și deodată au început să se întunece, să-și piardă strălucirea și să se prăbușească în pulbere. În câteva zile, munții de nasturi s-au transformat într-un morman de pudră gri. „Peste de staniu” este numele dat acestei „boali” a staniului alb. Și aceasta a fost doar o rearanjare a ordinii atomilor din cristalele de staniu. Staniul, trecând de la un soi alb la unul gri, se sfărâmă în pulbere.

Atât staniul alb, cât și cel gri sunt cristale de staniu, dar la temperaturi scăzute structura lor cristalină se modifică și, ca urmare, proprietățile fizice ale substanței se modifică. Atât staniul alb, cât și cel gri sunt cristale de staniu, dar la temperaturi scăzute structura lor cristalină se modifică și, ca urmare, proprietățile fizice ale substanței se modifică.






Anizotropia se observă în principal în monocristale. În policristale (de exemplu, într-o bucată mare de metal), anizotropia nu apare în stare normală. Policristalele constau dintr-un număr mare de granule mici de cristal. Deși fiecare dintre ele are anizotropie, din cauza dezordinei aranjamentului lor, corpul policristalin în ansamblu își pierde anizotropia.




Este posibil să perturbați aranjamentul particulelor într-un cristal numai dacă acesta începe să se topească. Atâta timp cât există o ordine de particule, există o rețea cristalină, un cristal există. Dacă structura particulelor este perturbată, înseamnă că cristalul s-a topit - s-a transformat în lichid sau s-a evaporat - s-a transformat în abur.

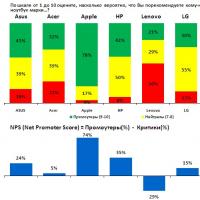 Urmărim fidelitatea clienților
Urmărim fidelitatea clienților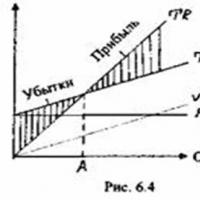 Care este pragul de profitabilitate?
Care este pragul de profitabilitate? Unde să lucrezi cu educația unui sociolog
Unde să lucrezi cu educația unui sociolog Ritualuri pentru a-ți demite inamicul de la locul de muncă Cum să-ți concediezi șeful
Ritualuri pentru a-ți demite inamicul de la locul de muncă Cum să-ți concediezi șeful 301 83 sistem tehnologic unificat
301 83 sistem tehnologic unificat Licenta pentru transport persoane
Licenta pentru transport persoane Ofertele sunt de următoarele tipuri
Ofertele sunt de următoarele tipuri