A reakciósebesség fontossága az analitikus kémia bemutatásában. Kémiai előadás: „A kémiai reakciók sebessége. A reagensek érintkezési felülete
A prezentációk előnézetének használatához hozzon létre magának egy Google-fiókot (fiókot), és jelentkezzen be: https://accounts.google.com
Dia feliratok:
Kémiai reakció sebessége
Kutatási célok: 1. Fogalmazza meg a kémiai reakció sebességének fogalmát. 2. Kísérletileg azonosítsa a kémiai reakció sebességét befolyásoló tényezőket.
A teljes térfogatban 2CO (g) + O 2 (g) = 2CO 2 (g) 2HBr (g) ↔H 2 (g) + Br 2 (g) NaOH (p) + HCl (p) = NaCl ( p) + H 2 O (folyékony) F (szilárd) + S (szilárd) = FeS (szilárd) Menjen a határfelületre CaCO 3 (szilárd) ↔CaO (szilárd) + CO 2 (gáz) CO 2 (gáz) + С (s) = 2CO (g) 4H 2 O (l) + 3Fe (s) ↔4H 2 (g) + Fe 3 O 4 (s) A reakciók osztályozása fázisösszetétel szerint
Homogén reakció átlagos sebessége A homogén reakció sebességét az egyik anyag koncentrációjának időbeli változásának változása határozza meg υ = - / + ΔC Δt mol l s
A heterogén reakció átlagos sebességét a reakcióba lépő vagy a reakció eredményeként kialakult anyag mennyiségének változása határozza meg, egységnyi idő és felület egység között. Az interakció csak az S - anyagok közötti határfelületen fordul elő. felszíni terület
A kémiai reakció sebességét befolyásoló tényezők A reakcióba lépő anyagok jellege Koncentráció Hőmérséklet Katalizátor, inhibitor Érintkező terület A reakció akkor következik be, amikor a reakcióba lépő anyagok molekulái ütköznek, sebességét az ütközések száma és erőssége (energiája) határozza meg
A reakcióba lépő anyagok jellege Az anyagok reaktív aktivitását meghatározza: a kémiai kötések jellege szerint az arány nagyobb az ionos és kovalens poláris kötésekkel rendelkező anyagoknál (szervetlen anyagok), alacsonyabb a kovalens alacsony polaritású és nem poláros kötések (szerves anyagok) υ (Zn + HCl = H 2 + ZnCl 2)> υ (Zn + CH 3 COOH = H 2 + Zn (CH3COO) 2 szerkezetük szerint, a sebesség nagyobb a fémeknél, amelyek az elektronok könnyebb felvétele (az atom nagy sugarával), a sebesség nagyobb a nemfémeknél, amelyek könnyebben fogadják el az elektronokat (az atom kisebb sugarával) υ (2K + 2 H 2 O = H 2 + 2KOH )> υ (2Na + 2H20 = H2 + 2NaOH)
Jacob Van't Hoff (1852-1911) A hőmérséklet növeli a molekuláris ütközések számát. Van't Hoff-szabály (egy kísérleti reakcióvizsgálat alapján megfogalmazva) 0 ° C és 100 ° C közötti hőmérséklet-tartományban, amikor a hőmérséklet 10 fokonként emelkedik, a kémiai reakció sebessége 2-4-szeresére nő : Van't Hoff szabályának nincs törvényereje. A laboratóriumi technológia tehát tökéletlen volt: kiderült, hogy a hőmérsékleti együttható jelentős hőmérsékleti tartományban nem állandó, lehetetlen volt mind a nagyon gyors (ezredmásodpercekben előforduló), mind a nagyon lassú (több ezer évet igénylő) reakciókat tanulmányozni. bonyolult alakú molekulák (például fehérjék) nem engedelmeskednek a Van't Hoff szabálynak. v = v 0 ∆ τ / 10 a Van't Hoff hőmérsékleti együttható
Koncentráció Az anyagok kölcsönhatásához molekuláiknak ütközniük kell. Az ütközések száma arányos a reagáló anyagok részegységeinek térfogategységére eső számával, azaz moláris koncentrációjuk. A tömeghatás törvénye: Az elemi kémiai reakció sebessége arányos a reagensek moláris koncentrációinak szorzatával, együtthatókkal megegyező hatványokra emelve: 1867-ben K. Guldberg és P. Waage megfogalmazták a cselekvési törvények A + b B d D + f F v = k C (A) a c (B) bk a reakciósebesség állandója (v = k a c (A) = c (B) = 1 mol / l)
Érintkezési terület A heterogén reakció sebessége közvetlenül arányos a reagensek érintkezési felületével. Őrlés és keverés közben a reagensek érintkezési felülete megnő, míg a reakció sebessége nő A heterogén reakció sebessége a következőktől függ: a) a reagensek fázishatárig történő betáplálásának sebességétől; b) a reakció sebessége a határfelületen, amely ennek a felületnek a területétől függ; c) a reakciótermékek eltávolításának sebessége a fázishatárról.
Profilszint „3” -nál - 13. bek., 126–139. Oldal, gyakorlat. 1. o. 140. A „4 -ről” - 13. § 126-139. O., 1.2. Gyakorlat, 140. o. „5” - 13. § 126-139. Oldal, 4.5. Gyakorlat, 140. oldal. Alapszint „3” -nál - 12. §, 49–55. Oldal, gyakorlat. 5. o. 63. A „4” -ről - 12. bek. 49-55, 1. feladat, 63. o. „5-ről” - 12. bek. 49-55, 2. feladat, 63. o.
Folytassa a mondatot: "Ma a leckében megismételtem ..." "Ma a leckében megtanultam ..." "Ma a leckében megtanultam ..."
http://www.hemi.nsu.ru/ucheb214.htm http://www.chem.msu.su/rus/teaching/Kinetics-online/welcome.html O.S. Gabrielyan. Kémia. 11. évfolyam. Alapszintű. Tankönyv az általános oktatáshoz oktatási intézmények, M., túzok, 2010 I. I. Novoshinsky, N.S. Novoshinskaya. Kémia. 10-es fokozat. Bemutató oktatási intézmények, M., "ONYX 21. század"; "Béke és oktatás", 2004 OS Gabrielyan, GG Lysova, AG Vvedenskaya. Kémiatanár kézikönyve. 11. évfolyam M., túzok. 2004 K. K. Kurmasheva. Kémia táblázatokban és diagramokban. M., "Új lista". 2003 N.B. Kovalevszkaja. Kémia táblázatokban és diagramokban. M., "Kiadói Iskola 2000". 1998 P. A. Orzhekovsky, N. N. Bogdanova, E. Yu. Vasyukova. Kémia. Feladatok gyűjtése. M. " Eksmo ", 2011-es fotók: http://www.google.ru/ Irodalom:
Köszönöm a leckét!
A témában: módszertani fejlesztések, előadások és jegyzetek
Többszintű csoportmunka a lehetőségekről a "Kémiai reakció sebessége. Kémiai egyensúly" témában ....
A leckét moduláris technológiában hozták létre ukránul. A leckét egy mellékelt prezentáció kíséri ....
Általánosító lecke a „Kémiai reakciók sebessége. Kémiai egyensúly ". Cél: A hallgatók elméleti ismereteinek általánosítása a kémiai reakció sebességéről, a hamarosan befolyásoló tényezőkről ...
Az egyes diák bemutatásának leírása:
1 dia
Diák leírása:
Analitikai reakciók oldatokban Analitikai reakciók oldatokban, reverzibilis és irreverzibilis Kémiai egyensúly A tömeghatás törvénye, kémiai egyensúlyi állandó Az elemzési reakciók egyensúlyának elmozdulását befolyásoló tényezők
2 dia
Diák leírása:
A kémiai reakciók típusai az analitikai kémiaban sav-bázis reakciók - protontranszfer H + redox reakciók (ORR) - elektron transzfer reakciók ē komplex reakcióval - reakciók elektronpárok átadásával és kötések kialakulásával a donor-akceptor mechanizmusával a lerakódási reakcióból - heterogén reakció oldatban
3 dia
Diák leírása:
A reverzibilis reakciókat széles körben alkalmazzák a kvantitatív elemzésben, azaz egyidejűleg két ellentétes irányban haladva: aA + bB ↔ cC + dD A reakciótermékek képződésének irányában haladó reakciót közvetlen aA + bB → cC + dD-nek nevezzük A reakció a kiindulási anyagok képződésének irányában halad - fordított cC + dD → aA + bB Elvileg minden természetben előforduló reakció reverzibilis, de azokban az esetekben, amikor a fordított reakció nagyon gyenge, a reakciókat gyakorlatilag visszafordíthatatlannak tekintik. Ezek általában azokat a reakciókat foglalják magukba, amelyek során az egyik keletkező termék elhagyja a reakció gömböt, azaz. csapadék, gáz formájában szabadul fel, rosszul disszociálható anyag (például víz) keletkezik, a reakció nagy mennyiségű hő felszabadulásával jár.
4 dia
Diák leírása:
A kémiai egyensúly állapota csak reverzibilis folyamatokra jellemző. A reverzibilis reakciókban az előremenő reakció sebessége kezdetben maximális értékkel rendelkezik, majd a reakciótermékek képződéséhez felhasznált kiindulási anyagok koncentrációjának csökkenése miatt csökken. A fordított reakciónak a kezdeti pillanatban van egy minimális sebessége, amely növekszik, ha a reakciótermékek koncentrációja növekszik. Így eljön az a pillanat, amikor az előre- és hátrafelé irányuló reakciók sebessége egyenlővé válik. A rendszer ezen állapotát kémiai egyensúlynak nevezzük kpr = krev
5 dia
Diák leírása:
1864 - 1867 -ben Guldberg és Vaage norvég tudósok megalkották a tényleges tömegek törvényét (a koncentrációkat cselekvő tömegek alatt értették. Akkor a koncentráció kifejezést még nem ismerték, később Van't Hoff vezette be): a vegyi anyag aránya a reakció egyenesen arányos a reaktánsok koncentrációinak szorzatával, egyenlő a megfelelő sztöchiometriai együtthatókkal. Az aA + bB = cC + dD típusú reverzibilis reakció esetén a tömegek hatástörvénye szerint az előre- és a fordított reakció sebessége egyenlő: vpr = kpr [A] a [B] v, vrev = krev [C] c [D] d. Ha vpr = vrev, akkor kpr [A] a [B] in = krev [C] c [D] d, innen K = krev / kpr = [C] c [D] d / [A] a [B] ... Így az egyensúlyi állandó a reakciótermékek koncentrációjának szorzatának és a kiindulási anyagok koncentrációjának szorzatának aránya. Az egyensúlyi állandó egy dimenzió nélküli mennyiség, mivel az anyagok koncentrációjától és mennyiségétől függ.
6 dia
Diák leírása:
A K értékét, amely a reagensek egyensúlyi koncentráció-arányának állandóságát jellemzi állandó hőmérsékleten, Van't Hoff nevezte egyensúlyi állandónak. Az egyensúlyi állandó a kémiai egyensúly állapotának egyik mennyiségi jellemzője. Feladat: írjon kifejezést a következő reakciók egyensúlyi állandójára: H2 + I2 ↔ 2HI; K = 2 / N2 + 3H2 -2NH3; K = 2/3
7 dia
Diák leírása:
A kémiai egyensúly elmozdulásának irányát a koncentráció, a hőmérséklet és a nyomás változásával a Le Chatelier-elv határozza meg: ha az egyensúlyi rendszerre hatással van (a koncentráció, a hőmérséklet, a nyomás változása), akkor a rendszer egyensúlya elmozdul e hatás gyengítése felé LE CHATELIER Henri Louis
8 dia
Diák leírása:
Az A + B ↔ C + D reakció esetén a koncentráció változása Ha a kiindulási anyagok koncentrációja növekszik, akkor az egyensúly a reakciótermékek képződése felé tolódik el, azaz. jobbra A + B → C + D, ha a kiindulási anyagok koncentrációja csökken, akkor az egyensúly a kiindulási anyagok felé tolódik, azaz balra A + B ← C + D, ha a reakciótermékek koncentrációja növekszik, akkor az egyensúly elmozdul a kiindulási anyagok képződése felé, azaz balra A + B ← C + D, ha a reakciótermékek koncentrációja csökken, akkor az egyensúly a reakciótermékek képződése felé tolódik el, azaz jobbra, A + B → C + D
9 dia
Diák leírása:
Az A + B ↔ C + D reakcióhoz 2) A hőmérséklet változását a reakció exoterm folyamat során bekövetkező hőhatása határozza meg (a reakció negatív értéke) - ha a hőmérséklet csökken, akkor az egyensúly elmozdul a reakciótermékek, azaz jobbra A + B → C + D, ha a hőmérséklet emelkedik, akkor az egyensúly a kiindulási anyagok felé tolódik el, azaz balra A + B ← C + D endoterm folyamatban (a reakció pozitív értéke) - ha a hőmérséklet emelkedik, akkor az egyensúly a reakciótermékek képződése felé tolódik el, azaz jobbra A + B → C + D, ha a hőmérséklet csökken, akkor az egyensúly elmozdul a kiindulási anyagok képződése felé, azaz balra A + B ← C + D
1. dia
2. dia
 A KÉMIAI REAKCIÓK OSZTÁLYOZÁSA FIZIKA (AGGREGÁT ÁLLAPOT) SZÁMÁRA Jellemző: a reakcióelegy teljes térfogatában fordulnak elő (a reagensek és a reakciótermékek különböző fázisokban vannak) S (szilárd) + O2 (g) = SO2 (g) Zn (szilárd) + 2HCI (g) = ZnCl2 (g) + H2 (d) Jellemző: áramlás az interfészen
A KÉMIAI REAKCIÓK OSZTÁLYOZÁSA FIZIKA (AGGREGÁT ÁLLAPOT) SZÁMÁRA Jellemző: a reakcióelegy teljes térfogatában fordulnak elő (a reagensek és a reakciótermékek különböző fázisokban vannak) S (szilárd) + O2 (g) = SO2 (g) Zn (szilárd) + 2HCI (g) = ZnCl2 (g) + H2 (d) Jellemző: áramlás az interfészen
3. dia
 A REAKCIÓK RÁMA Homogén reakció sebessége A heterogén reakció sebessége A (g) + B (g) = C (g) ∆V = V2-V1 ∆ t = t2-t1 V (hom) = ∆V / (∆ t * V ) C = V / V (mol / l) V (gom) = ± ∆С / ∆ t (mol / l * s) V (het) = ± ∆V / (S * ∆ t) (mol / m ^ 2 * s)
A REAKCIÓK RÁMA Homogén reakció sebessége A heterogén reakció sebessége A (g) + B (g) = C (g) ∆V = V2-V1 ∆ t = t2-t1 V (hom) = ∆V / (∆ t * V ) C = V / V (mol / l) V (gom) = ± ∆С / ∆ t (mol / l * s) V (het) = ± ∆V / (S * ∆ t) (mol / m ^ 2 * s)
4. dia
 A kémiai reakció sebességét befolyásoló tényezők Koncentráció A + B = C + D V = k [A] * [B] A reaktánsok jellege Érintkezőfelület hőmérsékleti katalizátor
A kémiai reakció sebességét befolyásoló tényezők Koncentráció A + B = C + D V = k [A] * [B] A reaktánsok jellege Érintkezőfelület hőmérsékleti katalizátor
5. dia
 1. feladat Egy bizonyos időpontban a klórkoncentráció az edényben, amelyben a H2 + Cl2 = 2HCl reakció lejátszódik, 0,06 mol / L volt. 5 mp után. A klórkoncentráció 0,02 mol / l volt. Mekkora ennek a reakciónak az átlagos sebessége a megadott időszakban? Adott C1 (Cl2) = 0,06 mol / L C2 (Cl2) = 0,02 mol / L ∆ t = 5 mp V =? Megoldás H2 + Cl2 = 2HCI V = - (C2 - C1) / ∆ t = (0,02-0,06) / 5 = = 0,008 (mol / L * s) Válasz: V = 0,008 (mol / L * s)
1. feladat Egy bizonyos időpontban a klórkoncentráció az edényben, amelyben a H2 + Cl2 = 2HCl reakció lejátszódik, 0,06 mol / L volt. 5 mp után. A klórkoncentráció 0,02 mol / l volt. Mekkora ennek a reakciónak az átlagos sebessége a megadott időszakban? Adott C1 (Cl2) = 0,06 mol / L C2 (Cl2) = 0,02 mol / L ∆ t = 5 mp V =? Megoldás H2 + Cl2 = 2HCI V = - (C2 - C1) / ∆ t = (0,02-0,06) / 5 = = 0,008 (mol / L * s) Válasz: V = 0,008 (mol / L * s)
6. dia
 2. feladat Hogyan változik a reakció sebessége FeCl3 + 3KCNS = Fe (CNS) 3 + 3KCl vizes oldatban, ha a reakcióelegyet kétszer vízzel hígítjuk. Adott C (ionok)< 2 раза V2/V1=? Решение Fe(3+) + 3CNS(-) = Fe(CNS)3 V =k*^3 пусть до разбавления: х = Y = ^3 В результате разбавления концентрация ионов уменьшается: x/2 = y/2 = V2/V1 = k*(x/2)*(y/2)^3 = 16 Ответ: V2/V1 = 16 ^3 – в степени 3
2. feladat Hogyan változik a reakció sebessége FeCl3 + 3KCNS = Fe (CNS) 3 + 3KCl vizes oldatban, ha a reakcióelegyet kétszer vízzel hígítjuk. Adott C (ionok)< 2 раза V2/V1=? Решение Fe(3+) + 3CNS(-) = Fe(CNS)3 V =k*^3 пусть до разбавления: х = Y = ^3 В результате разбавления концентрация ионов уменьшается: x/2 = y/2 = V2/V1 = k*(x/2)*(y/2)^3 = 16 Ответ: V2/V1 = 16 ^3 – в степени 3
7. dia
 3. feladat Hogyan változik a reakciósebesség, ha a hőmérséklet 55-100 ° C-ra emelkedik, ha ennek a reakciónak a hőmérsékleti együtthatója 2,5? Adott γ = 2,5 t1 = 55 't2 = 100' Vt2 / Vt1 =? Megoldás = 2,5 * ((100-55)/10) = = 25 ^ 4,5 = (5/2) ^ 9/9 = 43,7 Válasz: a reakciósebesség 43,7-szeresére nő
3. feladat Hogyan változik a reakciósebesség, ha a hőmérséklet 55-100 ° C-ra emelkedik, ha ennek a reakciónak a hőmérsékleti együtthatója 2,5? Adott γ = 2,5 t1 = 55 't2 = 100' Vt2 / Vt1 =? Megoldás = 2,5 * ((100-55)/10) = = 25 ^ 4,5 = (5/2) ^ 9/9 = 43,7 Válasz: a reakciósebesség 43,7-szeresére nő
8. dia
 4. feladat Ha a hőmérséklet 30 ° C-kal emelkedik, egyes reakciók sebessége 64-szeresére nő. Mennyi a reakció sebességének hőmérsékleti együtthatója? Adott Vt2 / Vt1 = 64 t2 = 30 ’γ =? Megoldás = γ ^ 3 64 = γ ^ 3 γ = 4 Válasz: a reakciósebesség hőmérsékleti együtthatója 4.
4. feladat Ha a hőmérséklet 30 ° C-kal emelkedik, egyes reakciók sebessége 64-szeresére nő. Mennyi a reakció sebességének hőmérsékleti együtthatója? Adott Vt2 / Vt1 = 64 t2 = 30 ’γ =? Megoldás = γ ^ 3 64 = γ ^ 3 γ = 4 Válasz: a reakciósebesség hőmérsékleti együtthatója 4.
9. dia
 Teszt: az ismeretek konszolidálása 1. A reakciósebesség csökkentése érdekében szükséges: a) növelni a reaktánsok koncentrációját b) katalizátort vezetni a rendszerbe c) növelni a hőmérsékletet d) csökkenteni a hőmérsékletet 2. A reakció legnagyobb sebesség: a) semlegesítés b) kén égése levegőben in) magnézium oldása savban d) réz-oxid redukciója hidrogénnel 3. Jelölje a homogén reakciót. a) CaO + H2O = Ca (OH) 2 b) S + O2 = SO2 c) 2CO + O2 = 2CO2 d) MgCO3 MgO + CO2 4. Jelölje meg a heterogén reakciót. a) 2CO + O2 = 2CO2 b) H2 + Cl2 = 2HCl c) 2SO2 + O2 = 2SO2 (kat. V2O5) d) N2O + H2 = N2 + H2O 5. Vegye figyelembe, hogy melyik reakció egyaránt homogén és katalitikus. a) 2SO2 + O2 = 2SO3 (kat. NO2) b) CaO + CO2 = CaCO3 c) H2 + Cl2 = 2HCI d) N2 + 3H2 = 2NH3 (macska Fe)
Teszt: az ismeretek konszolidálása 1. A reakciósebesség csökkentése érdekében szükséges: a) növelni a reaktánsok koncentrációját b) katalizátort vezetni a rendszerbe c) növelni a hőmérsékletet d) csökkenteni a hőmérsékletet 2. A reakció legnagyobb sebesség: a) semlegesítés b) kén égése levegőben in) magnézium oldása savban d) réz-oxid redukciója hidrogénnel 3. Jelölje a homogén reakciót. a) CaO + H2O = Ca (OH) 2 b) S + O2 = SO2 c) 2CO + O2 = 2CO2 d) MgCO3 MgO + CO2 4. Jelölje meg a heterogén reakciót. a) 2CO + O2 = 2CO2 b) H2 + Cl2 = 2HCl c) 2SO2 + O2 = 2SO2 (kat. V2O5) d) N2O + H2 = N2 + H2O 5. Vegye figyelembe, hogy melyik reakció egyaránt homogén és katalitikus. a) 2SO2 + O2 = 2SO3 (kat. NO2) b) CaO + CO2 = CaCO3 c) H2 + Cl2 = 2HCI d) N2 + 3H2 = 2NH3 (macska Fe)
10. dia
 Teszt: az ismeretek konszolidálása 6. Jelölje meg, hogyan változik a 2NO2 = N2O4 bimolekuláris gázreakció sebessége az NO2 koncentrációjának háromszoros növekedésével. a) 3 -szoros növekedés b) 6 -szoros csökkenés c) 9 -szeres növekedés d) 6 -szoros növekedés 7. Jelölje meg, hogy melyik folyamat felel meg a kémiai reakció sebességére vonatkozó tömeghatás kifejezésének V = k ^ x . a) S + O2 = SO2 b) 2H2 + O2 = 2H2O c) 2CO + O2 = 2CO2 d) N2 + O2 = 2NO 8. Vegye figyelembe, hogy melyik folyamatsebesség nem változik, ha a reakcióedényben a nyomást növelik (t változtatás nélkül) ). a) 2NO + O2 = 2NO2 b) H2 + Cl2 = 2HCl c) CaO + H2O = Ca (OH) 2 d) N2O4 = 2NO2 9. Számítsa ki, hogy mennyi a reakciósebesség hőmérsékleti együtthatója, ha a hőmérséklet 40 fokkal csökken C, a sebesség 81 -szer csökkent.
Teszt: az ismeretek konszolidálása 6. Jelölje meg, hogyan változik a 2NO2 = N2O4 bimolekuláris gázreakció sebessége az NO2 koncentrációjának háromszoros növekedésével. a) 3 -szoros növekedés b) 6 -szoros csökkenés c) 9 -szeres növekedés d) 6 -szoros növekedés 7. Jelölje meg, hogy melyik folyamat felel meg a kémiai reakció sebességére vonatkozó tömeghatás kifejezésének V = k ^ x . a) S + O2 = SO2 b) 2H2 + O2 = 2H2O c) 2CO + O2 = 2CO2 d) N2 + O2 = 2NO 8. Vegye figyelembe, hogy melyik folyamatsebesség nem változik, ha a reakcióedényben a nyomást növelik (t változtatás nélkül) ). a) 2NO + O2 = 2NO2 b) H2 + Cl2 = 2HCl c) CaO + H2O = Ca (OH) 2 d) N2O4 = 2NO2 9. Számítsa ki, hogy mennyi a reakciósebesség hőmérsékleti együtthatója, ha a hőmérséklet 40 fokkal csökken C, a sebesség 81 -szer csökkent.
Rossz álmokban álmodik már a periódusos rendszerről? A reakcióegyenletek pedig nem a fejemben alakultak ki tiszta megoldások de abszolút káosz? Ne aggódj túl hamar! A kémia nem könnyű és pontos tudomány, megértésére figyelmet kell fordítani, a tankönyvekben pedig gyakran érthetetlen szövegeket írnak, amelyek mindent bonyolítanak. A kémiai előadások segítségére lesznek - informatívak, strukturáltak és egyszerűek. Nem csak a víz minden formáját megismerheti, hanem képes lesz meglátni és pontosan emlékezni is rájuk. Mostantól a képletek és egyenletek érthetőek lesznek az Ön számára, és a problémamegoldás nem okoz problémát. Ezenkívül könnyedén lenyűgözheti osztálytársait és tanárait egy fényes bemutatóval, amely lehetővé teszi a legmagasabb pontszámok megszerzését az órán. A kémiai ismeretek ragyogóak lesznek, és a kémiáról szóló prezentációk, amelyek ingyenesen letölthetők az erőforrásunkból, ékszerészekké válnak tudásotokban.
A biológiai előadások kiváló társai lesznek a természettudományok tanulmányozásának is: e szövetséges nagy tudományok közötti kapcsolatot nehéz figyelmen kívül hagyni.
Állami költségvetés oktatási intézmény magasabb szakképzés Az Egészségügyi Minisztérium "Kazan State Medical University" Orosz Föderáció MEDIKO-GYÓGYSZERKOLÓGIA Az analitikus kémia fejlődésének története Összeállította: Davletshina Gulnaz R csoport
Az analitikus kémia az anyagok kémiai összetételének és szerkezetének meghatározására szolgáló módszerek tudománya. A COP ezen meghatározása azonban teljesnek tűnik. Az analitikai kémia tárgya az analitikai módszerek fejlesztése és gyakorlati megvalósítása, valamint az elméleti alapok átfogó tanulmányozása. analitikai módszerek... Ez magában foglalja az elemek és vegyületeik különböző közegekben és aggregációs állapotokban való létformáinak tanulmányozását, a koordinációs vegyületek összetételének és stabilitásának, az anyag optikai, elektrokémiai és egyéb jellemzőinek meghatározását, a kémiai reakciók sebességének tanulmányozását, a metrológiai jellemzők meghatározását módszerek stb. új elemzési módszerek, valamint a tudomány és a technika modern fejlődésének elemzési célokra történő felhasználása.

A feladattól, az analit tulajdonságaitól és egyéb körülményektől függően az anyagok összetételét különböző módon fejezik ki. Kémiai összetétel az anyagokat az elemek vagy ezek oxidjainak vagy más vegyületeinek tömegarányával (%), valamint a mintában ténylegesen jelen lévő egyes kémiai vegyületek vagy fázisok, izotópok stb. tartalmával jellemezhetjük. Az ötvözetek összetételét általában az alkotó cement tömegrésze (%); összetett sziklák, ércek, ásványi anyagok stb. az elemek tartalma bármely vegyületükben, leggyakrabban oxidokban.

Elméleti alap Az analitikus kémiát a természettudomány alapvető törvényei alkotják, például DI Mendelejev periodikus törvénye, az anyag- és energiamegmaradás törvényei, az anyag összetételének állandósága, a ható tömegek stb. fizika, szervetlen, szerves, fizikai és kolloid kémia, elektrokémia, kémiai termodinamika, megoldáselmélet, metrológia, információelmélet és sok más tudomány.

Az analitikai kémia tudományos és gyakorlati jelentőséggel bír. Szinte az összes alapvető kémiai törvényt felfedezték ennek a tudománynak a módszereivel. A különféle anyagok, termékek, ércek, ásványi anyagok, holdtalaj, távoli bolygók és más égitestek összetételét az analitikai kémia módszereivel hozták létre, a periódusos rendszer számos elemének felfedezését a pontos analitikai kémia módszerei. Az analitikai kémia fontossága

Az analitikus kémia és az analitikai technikák számos gyakorlati technikáját ismerték az ókorban. Ez elsősorban a vizsgálati módszer vagy a vizsgálati elemzés, amelyet "szárazon" hajtottak végre, vagyis a minta feloldása és oldatok használata nélkül. A vizsgálati elemzés módszereit a nemesfémek tisztaságának szabályozására, valamint ércek, ötvözetek stb. Tartalmának megállapítására használták. gyártási folyamat nemesfémek megszerzése. Ezeket az elemzési módszereket az ókori Egyiptomban és Görögországban alkalmazták, Kijevi Ruszban is ismertek. Gyakorlati érték az oldatban a reakció ekkor kicsi volt. Az analitikai kémia fejlődésének főbb szakaszai

Ipari fejlesztés és különféle iparágak a 17. század közepére. új elemzési és kutatási módszereket követelt, mivel a vizsgálati elemzések már nem tudták kielégíteni a vegyipar és sok más ipar igényeit. Ekkorra, a 17. század közepére. általában magukban foglalják az analitikus kémia megjelenését és magát a kémiát mint tudományt. Az ércek, ásványi anyagok és egyéb anyagok összetételének meghatározása nagy érdeklődést váltott ki, és a kémiai elemzés ekkor vált a kémiai tudomány fő kutatási módszerévé. R. Boyle () fejlődött általános fogalmak a kémiai elemzésről. Megalapozta a modern kvalitatív elemzést a "nedves" módszerrel, vagyis oldatban történő reakciókkal, vezette az akkor ismert kvalitatív reakciók rendszerét, és számos újat javasolt (ammóniára, klórra stb.), alkalmazott lakmusz a savak és lúgok kimutatására, és más fontos felfedezéseket tett.

M. V. Lomonoszov () először szisztematikusan kezdte használni a mérlegeket a kémiai reakciók tanulmányozásában. 1756-ban kísérletileg megalapította a természet egyik alapvető törvényét, az anyagtömeg megőrzésének törvényét, amely a kvantitatív elemzés alapját képezte és nagy jelentőséggel bír az egész tudomány számára. MV Lomonosov számos kémiai elemzési és kutatási módszert fejlesztett ki, amelyek a mai napig nem veszítették el jelentőségüket (szűrés vákuumban, gravimetriai elemzések stb.). MV Lomonoszov érdeme az analitikai kémia területén többek között a gázelemzés alapjainak megalkotása, mikroszkóp használata a kristályok alakjának kvalitatív elemzéséhez, ami később mikrokristályoszkópos elemzés kidolgozásához vezetett, refraktométer tervezéséhez és egyéb eszközök. MV Lomonosov saját kutatásainak eredményeit és egy kutató vegyész, elemző és technikus tapasztalatait foglalta össze "A kohászat vagy ércbányászat első alapjai" című könyvében (1763), amely óriási hatással volt az analitikai kémia és a kapcsolódó mezők, valamint a kohászat és az ércbányászat.

A pontos kémiai elemzési módszerek alkalmazása lehetővé tette számos természetes anyag és technológiai feldolgozás termékének összetételének meghatározását, a kémia számos alaptörvényének megállapítását. A.L. Lavoisier () meghatározta a levegő, a víz és más anyagok összetételét, és kidolgozta az égés oxigénelméletét. Analitikai adatok alapján D. Dalton () kidolgozta az anyag atomisztikus elméletét, és megállapította az összetétel állandóságának és a többszörös arányoknak a törvényeit. J.L. Gay-Lussac () és A. Avogadro () megfogalmazta a gáztörvényeket.

M.V. Severgin () egy kolorimetriás elemzést javasolt az oldat színintenzitásának az anyag koncentrációjától való függése alapján, J. L. Gay-Lussac kifejlesztett egy titrimetrikus elemzési módszert. Ezek a módszerek a gravimetriás módszerekkel együtt alkotják a klasszikus analitikai kémia alapját, és mind a mai napig megőrizték jelentőségüket. Az új módszerekkel gazdagított analitikai kémia tovább fejlődött és javult. A 18. század végén. T. E. Lovits (), kidolgozva M. V. Lomonosov ötleteit, mikrokristályos elemzést készített, amely módszer a sók kvalitatív elemzésére kristályaik alakja alapján.

A 18. és 19. század végén. számos tudós, T. U. Bergman (), L. J. Tenard (), K. K. Klaus () és mások munkái alapján szisztematikusan kvalitatív elemzés... A kidolgozott séma szerint az elemzett oldatból a csoport reagensek hatását használták fel a kicsapódáshoz bizonyos csoportok elemeket, majd ezeken a csoportokon belül elvégezték az egyes elemek felfedezését. Ezt a munkát K.R.Fresenius () fejezte be, aki tankönyveket írt a minőségről és mennyiségi elemzésés megalapította az első analitikai kémiai folyóiratot (Zeitschrift fur analytische Chemie, ma Fresenius Z. anal. Chem.). Ugyanakkor I. Ya. Berzelius () és Yu. Liebikh () továbbfejlesztette és kifejlesztette a szerves vegyületek elemzésének módszereit a C, H, N stb. Fő elemek tartalmára vonatkozóan. A titrimetriás elemzés észrevehetően halad, jodometria, permanganatometria stb. a felfedezés az években történik. R. V. Bunsen () és G. R. Kirchhoff (). Spektrális elemzést javasolnak, amely az analitikus kémia egyik fő módszerévé válik, és folyamatosan fejlődik a mai napig.

DI Mendelejev () periódusos törvényének 1869-es felfedezése óriási hatást gyakorolt a kémia és más tudományok fejlődésére, és DI Mendelejev "A kémia alapjai" lett az alapja az analitikai kémia tanulmányozásának. Nagy jelentősége volt a szerves vegyületek szerkezetének elméletének A.M. Butlerov általi megalkotásának is. Jelentős hatást gyakorolt az analitikai kémia kialakulására és annak tanítására A. A. Menshutkin 1871-ben megjelent "Analitikai kémia". angol nyelvek... 1868-ban D.I. kezdeményezésére. Mendelejev és N.A. A Scientific Chemical Society létrehozása és a folyóirat megjelenése jótékony hatással volt különösen a hazai kémia és az analitikai kémia fejlődésére.

Az NS Kurnakov () által kidolgozott fizikai-kémiai elemzés a "kompozíció-tulajdonság" diagramok tanulmányozása alapján a kémia speciális szakaszává vált. A fizikai-kémiai analízis módszere lehetővé teszi a komplex rendszerekben képződött vegyületek összetételének és tulajdonságainak megállapítását, a rendszer tulajdonságainak összetételétől függően, az egyes vegyületek kristályos vagy más formában történő izolálása nélkül.

1903 -ban M. S. Tsvet () kromatográfiás elemzést javasolt hatékony módszer a hasonló tulajdonságú vegyületek szétválasztása az adszorpció és az anyag néhány egyéb tulajdonsága alapján. Ennek a módszernek az előnyeit csak néhány évtizeddel a felfedezése után értékelték teljes mértékben. A. Martin és R. Sing 1954 -ben Nobel -díjat kapott a partíciós kromatográfia kifejlesztéséért.

Az analitikai kémia elméletének továbbfejlesztése társul N. B. (Beketov) () kémiai reakciók egyensúlyi jellegének felfedezéséhez, valamint K. M. Guldberg () és II. A cselekvő tömegek törvényének Waage (). Azzal, hogy 1887 -ben megjelent S. Arrhenius () elektrolitikus disszociáció elmélete, az analitikus vegyészek a kémiai reakciók hatékony mennyiségi szabályozásának módszerét szerezték meg, és a kémiai termodinamika sikerei tovább bővítették ezeket a lehetőségeket. Az analitikus kémia tudományos alapjainak kialakításában alapvető szerepet játszott V. Ostwald () „Az analitikus kémia tudományos alapjai egy elemi prezentációban” című monográfiája, amely 1894 -ben jelent meg. L. V. Pisarzhevsky () és NA Shilova munkái () a redox folyamatok elektronikus elméletéről.

A XX. Század 20-as évei óta. a kvantitatív emissziós spektrális elemzés és az abszorpciós spektroszkópia intenzíven kezd fejlődni. A fényerősség fotoelektromos rögzítését lehetővé tevő eszközöket terveznek. 1925-ben Y. Geyrovsky () polarográfiai elemzést dolgozott ki, amiért 1959-ben Nobel-díjat kapott. Ugyanezekben az években kromatográfiás, radiokémiai és sok más elemzési módszert fejlesztettek és fejlesztettek. 1950 óta gyorsan fejlődik az E. Walsh által javasolt atomabszorpciós spektroszkópia.

Az ipar és a tudomány fejlődése új és kifinomult elemzési módszereket követelt az analitikus kémiától. Felmerült az igény a szennyeződések mennyiségi meghatározására a szint alatt és alatt. Kiderült például, hogy az úgynevezett tiltott szennyeződések (Cd, Pb stb.) Tartalma a rakétatechnika anyagában nem lehet magasabb, mint 10 ~ 5%, ha cirkóniumban hafniumtartalom a nukleáris technológiában a szerkezeti anyagnak kevesebbnek kell lennie, mint 0, 01%, a félvezető technológiájú anyagokban pedig a szennyeződések nem lehetnek nagyobbak, mint 10%. Ismeretes, hogy a germánium félvezető tulajdonságait csak azután fedezték fel, hogy ennek az elemnek a nagy tisztaságú mintáit megszerezték. A cirkóniumot eredetileg szerkezeti anyagként 2002-ben elutasították nukleáris ipar azon az alapon, hogy ő maga is gyorsan radioaktívvá vált, bár az elméleti számítások szerint ennek nem kellett volna. Később kiderült, hogy nem a cirkónium lett radioaktív, hanem a cirkónium -hafnium szokásos társa, amely cirkónium -anyagok szennyeződése.

Az analitikai kémia mai napját számos változás jellemzi: az elemzési módszerek arzenálja bővül, különösen a fizikai és biológiai irányban; automatizálás és elemzés matematizálása; helyi, roncsolásmentes, távoli, folyamatos elemzés technikáinak és eszközeinek létrehozása; a komponensek létezési formáival kapcsolatos problémák megoldásának megközelítése az elemzett mintákban; új lehetőségek megjelenése az elemzés érzékenységének, pontosságának és gyorsaságának növelésére; az elemzett tárgyak körének további bővítése. A számítógépeket ma már széles körben használják, a lézerek sokat tesznek, megjelentek a laboratóriumi munkák; Jelentősen megnőtt az analitikai ellenőrzés, főleg a környezetünk tárgyainak ellenőrzése. Fokozott az érdeklődés az analitikai kémia módszertani problémái iránt. Hogyan lehet egyértelműen meghatározni e tudomány tárgyát, milyen helyet foglal el a tudományos ismeretek rendszerében, legyen az alapvető vagy alkalmazott, mi serkenti fejlődését? Ezek és hasonló kérdések sok vita tárgyát képezték.

 Amire szüksége van egy vízipipa társalgó megnyitásához, és hogyan kell helyesen csinálni
Amire szüksége van egy vízipipa társalgó megnyitásához, és hogyan kell helyesen csinálni Hogyan indítsunk vállalkozást, és válasszunk fánk felszerelést
Hogyan indítsunk vállalkozást, és válasszunk fánk felszerelést Cégnyitás Montenegróban Nyisson céget Montenegróban
Cégnyitás Montenegróban Nyisson céget Montenegróban Az asztalosműhely, mint üzlet
Az asztalosműhely, mint üzlet Hogyan válasszunk üzleti irányt?
Hogyan válasszunk üzleti irányt? Minta egy fogászati rendelő üzleti terve
Minta egy fogászati rendelő üzleti terve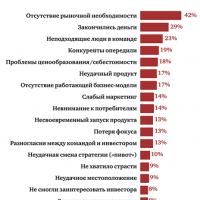 Öt legjobb üzleti ötlet, amelyek milliókat hoztak Milyen üzletet kell megnyitni, hogy ne menjen csődbe
Öt legjobb üzleti ötlet, amelyek milliókat hoztak Milyen üzletet kell megnyitni, hogy ne menjen csődbe